Руководитель
д.х.н., профессор ведущий научный сотрудник 8(3852)42-55-85
Недоля Нина Алексеевна
Кадровый состав
Недоля Нина Алексеевна - ведущий научный сотрудник, Ph.D. (Utrecht University, The Netherlands), д.х.н., профессор (nina@irioch.irk.ru)
Тарасова Ольга Анатольевна - старший научный сотрудник, к.х.н. (olga@irioch.irk.ru)
Направление научных исследований
Дивергентные реакции ненасыщенных карбанионов, генерируемых in situ из алкинов, диинов, енинов, 1,2- и 1,3-диенов под действием сверхоснований (n-BuLi, n-BuLi/t-BuOK), с гетерокумуленами как основа принципиально новой стратегии направленного конструирования фундаментальных гетероциклических структур – пирролов, циклобутанопирролинов, 4,4'-дипиррометанов, 1,2- и 2,3-дигидропиридинов, пиридинов, хинолинов, 3Н-азепинов, 4,5-дигидро-3Н-азепинов, 1,3-тиазолов, 4,5-дигидро-1,3-тиазолов, тиетанов, тиофенов, дигидротиофенов, тиопиранов, 2,7-дигидротиопирано[2,3-b]пирролов, дигидрофуранов и др. соединений с редкой N-, O-, S- и Si-функциональностью – активных фрагментов важнейших природных и синтетических биообъектов и функциональных материалов для передовых технологий.
Nedolya N.A. Novel Chemistry Based on Isothiocyanates and Polar Organometallics // Ph.D. Thesis, Utrecht University, The Netherlands (ISBN: 90-393-2071-3). – 1999. – 144 p.
Trofimov B.A., Nedolya N.A. Pyrroles and their Benzo Derivatives: Reactivity, in Comprehensive Heterocyclic Chemistry III. A Review of the Literature 1995–2007 // Eds. A.R. Katritzky, C.A. Ramsden, E.F.V. Scriven, R.J.K. Taylor. Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokyo: Elsevier. − 2008. − V. 3. − Р. 45−268.
Brandsma L., Nedolya N.A., Tarasova O.A., Trofimov B.A. Synthesis of Heterocyclic Compounds from Metallated Unsaturated Compounds and Isothiocyanates // ХГС. – 2000. – № 11. – С. 1443−1463.
Brandsma L., Nedolya N.A. Allenic Compounds and Isothiocyanates as Key Building Units in the Synthesis of Heterocycles. (Special Topic) // Synthesis. − 2004. − No. 5. − P. 735−745.
Недоля Н.А. Химия гетероциклических соединений в Иркутском институте химии им. А. Е. Фаворского СО РАН за 50 лет // ХГС. – 2008. – № 10. – С. 1443−1502.
Недоля Н.А., Трофимов Б.А. Реакции [1,7]-электроциклизации в синтезе производных азепинов // ХГС. – 2013. – № 1. – С. 166−190.
Недоля Н.А. Ацетиленовые и алленовые карбанионы в реакции с гетерокумуленами: простой путь к фундаментальным гетероциклам // ЖОрХ. – 2023. – Т. 59, вып. 10. – С. 1319−1350.
Основные научные результаты за 2020 - 2024 гг.
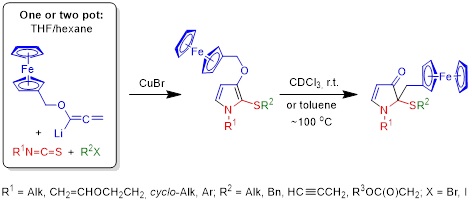
1. Однореакторный синтез пиррол-ферроценовых ансамблей и их перегруппировка в 2-(ферроценилметил)-1,2-дигидро-3H-пиррол-3-оны
Введение в реакцию с изотиоцианатами в качестве алленовой компоненты литиированного (ферроценилметокси)аллена обеспечивает простой выход к ранее неизвестным и недоступным иными путями гетерозамещённым ферроценсодержащим пирролам – 1-(алкил, циклоалкил, винилоксиэтил и арил)-2-(алкилсульфанил)-3-(ферроценилметокси)пирролам – перспективным базовым соединениям для дизайна новых поколений молекулярных сенсоров, ферромагнетиков, катализаторов, оптоэлектронных материалов, лекарственных препаратов и диагностических средств для медицины. Процесс осуществляется в одну или две препаративные стадии (в зависимости от природы алкилирующего агента).
Обнаружена неожиданная трансформация синтезированных 3-(ферроценилметокси)-1Н-пирролов в 1,2-дигидро-3H-пиррол-3-оны, протекающая как при комнатной температуре (в растворе CDCl3), так и при нагревании (в толуоле). На основе литературных и экспериментальных данных предполагается, что перегруппировка протекает по двум различным механизмам активации формальной [1,3]-O-to-C-миграции ферроценилметильной группы: через кислотно-индуцируемое генерирование ферроценилметил-карбокатиона (в CDCl3) или через тандемный O[1,3]-сигматропный сдвиг и перегруппировку Кляйзена (при нагревании).
Tarasova O.A., Nedolya N.A., Albanov A.I., BagryanskayaYu., Trofimov B.A. Synthesis of pyrrole-ferrocene ensembles and their rearrangement into 2-(ferrocenylmethyl)-1,2-dihydro-3H-pyrrol-3-ones // J. Organomet. Chem. − 2021. − V. 933. − ID 121651.
2. Трёхкомпонентные реакции литиированных пропаргиламинов, изотиоцианатов и функционализированных алкилирующих агентов: разработка и развитие концептуально новых подходов к однореакторному синтезу новых классов 1Н-пиррол-2-аминов и их производных
2.1. Синтез [(5-амино-1H-пиррол-2-ил)сульфанил]ацетатов и [5-амино-1H-пиррол-2-ил)сульфанил]ацетонитрилов
Замена α-литиированных алкоксиалленов монолитиированными пропаргиламинами в реакции с изотиоцианатами и алкил-2-бромацетатами или бромацетонитрилом привела к разработке простой и эффективной методологии однореакторной сборки ранее неизвестных представителей 1Н-пиррол-2-аминов − [(5-амино-1H-пиррол-2-ил)сульфанил]ацетатов и [5-амино-1H-пиррол-2-ил)сульфанил]ацетонитрилов − потенциальных лекарственных препаратов и/или их прекурсоров, ценных полупродуктов и многоцелевых строительных блоков для органического синтеза, фармакологии и материаловедения.
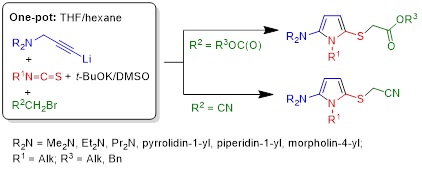
Tarasova O.A., Nedolya N.A., Albanov A.I., Trofimov B.A., Synthesis of 2-[(5-Amino-1H-pyrrol-2-yl)sulfanyl]acetic Acids Esters: One-Pot Assembly from Propargyl Amines, Isothiocyanates, and Alkyl 2-Bromoacetates // Synthesis. − 2019. − V. 51, No. 19. − P. 3697−3708.
Tarasova O.A., Nedolya N.A., Albanov A.I., Trofimov B.A., 2-Amino-5-(cyanomethylsulfanyl)-1H-pyrroles from Propargylamines, Isothiocyanates, and Bromoacetonitrile by One-Pot Synthetic Protocol // ChemistrySelect. − 2020. − V. 5, No. 19. − P. 5726−5731.
2.2. Однореакторный синтез 1-[2-(винилокси)этил]-1Н-пиррол-2-аминов и 1-винилпирролов на их основе
Разработаны новые простые и эффективные методы трёхкомпонентного синтеза нового ряда 1-[2-(винилокси)этил]- и 1-винил-5-сульфанил-1Н-пиррол-2-аминов. Показано, что 1-[2-(винилокси)этил]-замещённые пирролы, полученные в одну препаративную стадию из монолитиированных третичных пропаргиламинов, 2-(винилокси)этилизотиоцианата и алкилирующих агентов с высоким выходом (до 92%), легко превращаются (под действием системы t-BuOK/ДМСО) в соответствующие 1-винилпирролы (с выходом до 98%). Синтезированные соединения, содержащие высокореактивные и фармакофорные заместители, являются привлекательными объектами для биологических и медицинских исследований, а также синтонами и строительными блоками для дальнейшей разработки новых полезных продуктов и материалов путём простых химических манипуляций с участием как пиррольного ядра, так и функциональных заместителей.
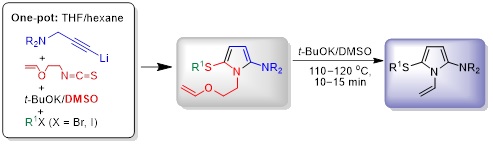
Tarasova O.A., Nedolya N.A., Albanov A.I., Trofimov B.A. An Efficient One-Pot Synthesis of 5-Sulfanyl-1-[2-(vinyloxy)ethyl]-1H-pyrrol-2-amines as Precursors of 1-Vinylpyrroles // Synthesis. − 2022. − V. 54, No. 18. − P. 4033−4048.
2.3. Самосборка 4,4'-дипиррометанов из нетрадиционных реагентов – пропаргиламинов, 2-(винилокси)этилизотиоцианата и алкилирующих агентов в основных условиях
Открыт концептуально новый подход к ранее неизвестным 4,4'-связанным дипиррометанам, базирующийся на использовании беспрецедентной технологии самосборки из нетрадиционных исходных материалов, а именно из легкодоступного 2-(винилокси)этилизотиоцианата и различных третичных пропаргиламинов и алкилирующих агентов. Вероятный механизм реакции, приводящей к образованию дипиррометанов, основные стадии которого подтверждены экспериментально, включает в себя ряд последовательных реакций, а именно: (1) монолитиирование пропаргиламина; (2) присоединение ацетиленового карбаниона к изотиоцианату; (3) ацетилен−алленовую изомеризацию образующегося N-[2-(винилокси)этил]бут-2-инимидотиоата лития в соответствующий алленилимидотиоат калия под действием системы t-BuOK/t-BuOH); (4) низкотемпературную (<15°C) внутримолекулярную циклизацию последнего в N-(5-амино-2-тиенил)-N-[2-(винилокси)этил]амид калия; (5) основно-индуцируемое расщепление C−O связи в N-[2-(винилокси)этильной] группе и отщепление винилоксид-аниона, приводящее к образованию ацетальдегида; (6) взаимодействие ацетальдегида с двумя молекулами N-(5-амино-2-тиенил)-N-[2-(винилокси)этил]амид-аниона, ведущее к образованию дитиенометанового N-анионного интермедиата; (7) ре-циклизацию последнего в дипиррометановый S-анионный интермедиат. Заключительное S-алкилирование приводит к недоступным известными методами 4,4'-дипиррометанам с выходом 22−51%. Весь процесс осуществляется за одну синтетическую операцию за очень короткое время (~10−15 мин, без учёта времени алкилирования).
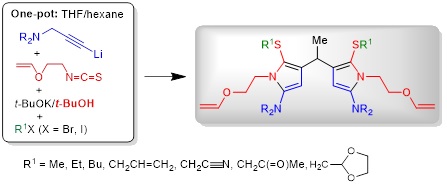
Следует отметить несколько важных моментов, касающихся обсуждаемой реакции: (1) N-[2-(винилокси)этил]-замещённый тиениламид-анион как источник ацетальдегида, его конденсация с ацетальдегидом в основных условиях, образование и ре-циклизация дитиенометанового N-анионного интермедиата в дипиррометановый S-анионный интермедиат (предшественник дипиррометана) ранее не были известны; (2) образование дипиррометана наблюдается только в присутствии протонодонора, в частности, t-BuOH; (3) реакция ацетальдегида с нейтральными молекулами как тиофен-2,5-диамина, так и 1-[2-(винилокси)этил]-1Н-пиррол-2-амина не протекает. Обращает на себя внимание высокая региоселективность процесса, приводящего исключительно к симметричным 4,4'-связанным дипиррометанам. 3,3'- и/или 3,4-дипиррометаны, а также N-винилпирролы среди продуктов не идентифицированы.
Nedolya N.A., Tarasova O.A., Albanov A.I., Klyba L.V., Trofimov B.A. Self-Assembly of 4,4'-Linked Dipyrromethanes from Unconventional Reactants – Propargylamines, 2-(Vinyloxy)ethyl Isothiocyanate, and Alkylating Agents Under Basic Conditions // J. Org. Chem. − 2024. − V. 89, No. 2. − P. 864−881.
3. Новый подход к синтезу разнообразно замещённых 2-(алкилсульфанил)хинолинов: однореакторная сборка из арилизотиоцианатов и ацетиленовых или алленовых карбанионов
Новая стратегия построения хинолинового кольца путём структурной реорганизации алкил-N-арилбута-2,3-диенимидотиоатов [1-аза-1,3,4-триенов, C=C=C−C(SAlk)=NAr], полученных из легкодоступных алленов или алкинов, арилизотиоцианатов и алкилирующих агентов, открывает простой и удобный подход к новым семействам хинолинов, содержащих различные заместители как в пиридиновом, так и в бензольном кольцах.
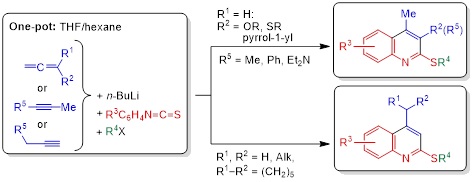
В частности, ранее неизвестные 4-этил-, 4-изопропил-, 4-неопентил-, 4-циклогексил-, 4-метил-3-алкокси-, 4-метил-3-(алкилсульфанил)-, 4-метил-3-(N,N-диэтиламино)-, 4-метил-3-фенил-, 4-метил-3-(1Н-пиррол-1-ил)-, 4-этил-3-метил-, 4-изопропил-3-метил-, 4-неопентил-3-метил-2-(алкилсульфанил)хинолины с F, Cl, Br, CF3, Me, OMe и NMe2 заместителями в различных положениях бензольного кольца были получены с помощью этой методологии.
Nedolya N.A., Tarasova O.A., Artem’ev A.V., Albanov A.I., Bagryanskaya I.Yu., Trofimov B.A. One-pot synthesis of 2-(alkylsulfanyl)quinolines from aryl isothiocyanates and allenes or alkynes // Eur. J. Org. Chem. – 2024. – V. 27, No. 13. – P. e202400033.